Урок за 13.05
Оксиди Карбону
Карбон утворює два оксиди: карбон (II) та (IV) оксиди.
Карбон (II) оксид (карбон монооксид, чадний газ) СО – отруйний безбарвний газ без запаху, легший за повітря, не розчиняється у воді і не реагує з нею.
У промисловості утворюється при спалюванні вуглецю або його органічних сполук за нестачі кисню:
відновленням СО2 розпеченим вугіллям:
CO2 + C = 2CO,
або при конверсії метану чи вугілля з водяною парою:
CH4 + H2O = CO + 3H2, C + H2O = CO + H2.
У лабораторії СО одержують дією сульфатної кислоти на НСООН при 100 0С:
HCOOH = CO + H2O.
Хімічні властивості.
1. За н.у. СО – індиферентний оксид. При 200 0С і тиску 15 мПа реагує з NaOH з утворенням натрій форміату HCOONa:
NaOH + CO = HCOONa.
Це показує, що СО формально є ангідридом мурашиної кислоти НСООН.
2. На повітрі СО горить блакитним полум’ям:
2CO + O2 = 2CO2.
3. На світлі реагує з хлором з утворенням фосгену COCl2 (гр. народжений світлом):
CO + Cl2 COCl2.
Це – дихлорангідрид вугільної кислоти H2CO3:
COCl2 + 2H2O = H2CO3 + 2HCl.
Фосген колись використовували як отруйний газ, зараз застосовують у синтезі органічних сполук.
4. При нагріванні відновлює оксиди металів:
4CO + Fe3O4 = 4CO2 + 3Fe.
5. З деякими d-металами (Fe, Co, Ni) утворює карбоніли:
4CO + Ni = [Ni(CO)4].
нікель тетракарбоніл
Карбоніли – комплексні сполуки з нейтральною внутрішньою сферою.
Карбон (IV) оксид (вуглекислий газ, карбонатний ангідрид) СО2 – безбарвний газ, без смаку і запаху, важчий за повітря. Малорозчинний у воді. Твердий СО2 називають “сухий лід”.
Утворюється в природі при окисненні органічних речовин (гнитті, горінні), виділяється при виверженні вулканів. Карбон (IV) оксид під назвою “лісовий газ” (gas silvestre) вперше описав Ван Гельмонт (Бельгія) у VІ ст., добувши його спалюванням дерева.
У лабораторії СО2 добувають дією кислот на СаСО3 в апараті Кіппа:
CaCO3 + 2HCl = CO2 + CaCl2 + H2O.
У промисловості СО2 добувають термічним розкладом СаСО3:
CaCO3 = CaO + CO2.
Молекула СО2 лінійна неполярна, тому вуглекислий газ погано розчинний у воді і полярних розчинниках.
Хімічні властивості.
1.Розчиняється у воді з утворенням слабкої вугільної кислоти:
H2O + CO2 D H2CO3.
2. Реагує з основними оксидами з утворенням карбонатів:
CaO + CO2 = CaCO3.
3. З лугами утворює карбонати і/або гідрогенкарбонати:
2NaOH + CO2 = Na2CO3 + H2O, NaOH + CO2 = NaHCO3.
Остання реакція відбувається при надлишку СО2:
Na2CO3 + H2O + CO2 = 2NaHCO3.
4. Не підтримує горіння. На цьому ґрунтується його якісне виявлення. Лише активні речовини віднімають Оксиген від вуглекислого газу:
2Mg + CO2 = 2MgO + C.
5. Бере участь у фотосинтезі:
6CO2 + 6H2O = C6H12O6 + 6O2.
Карбонатна кислота. Карбонати
Карбонатна кислота існує лише у водних розчинах. Це – слабка кислота, дисоціює ступінчато:
І ступінь: Н2СО3 ↔ НСО3– + Н+,
І ступінь: НСО3– ↔ СО32– + Н+.
Дисоціація за другим ступенем відбувається дуже незначною мірою.
Як двоосновна кислота утворює два типи солей: середні – карбонати (Na2CO3, CaCO3) і кислі – гідрогенкарбонати (KHCO3, Ba(HCO3)2).
Одержують карбонати дією СО2 на водні розчини лугів:
CO2 + Ba(OH)2 = BaCO3↓ + H2O.
Цю реакцію використовують для виявлення вуглекислого газу за помутнінням розчину лугу.
Усі гідрогенкабронати та карбонати лужних металів і амоніаку розчинні у воді.
Хімічні властивості.
1.Розчини карбонатів і гідрогенкабонатів, внаслідок гідролізу створюють лужне середовище (pH > 7):
Na2CO3 + Н2О ↔ NaHCO3 + NaOН.
Карбонати алюмінію, хрому (ІІІ), феруму (ІІІ) і купруму (ІІ) не існують, оскільки гідролізують необоротно:
CuCO3 + Н2О = Cu(OН)2↓ + СО2.
Якщо ж реакційну масу нагріти для видалення слідів води, то відбувається розкладання карбонату на оксид металу і вуглекислий газ:
2Сr(CO3)3 = Сr2O3 + 6CO2.
2. Дією кислот солі карбонатної кислоти розкладаються на вуглекислий газ і воду:
NaHCO3 + CH3COOH = CH3COONa + CO2 + H2O,
CaCO3 + 2HCl = CaCl2 + CO2 + H2O.
При цьому спостерігається виділення СО2 і спінення розчину, що використовують для того, щоб відрізнити карбонати від інших речовин.
3. При нагріванні усі солі карбонатної кислоти (крім солей лужних металів) розкладаються на оксид металу і СО2:
ВaCO3 = ВaО + CO2, 2Са(HCO3)2 = СаСО3 + CO2 + H2O.
Гідрогенкарбонати лужних металів утворюють середні солі, які не розкладаються при нагріванні:
2NаHCO3 = Nа2СО3 + CO2 + H2O.
Застосування оксигеновмісних сполук Карбону.
Карбон (ІІ) оксид СО використовують у металургії як відновник оксидів металів. Він є складовою газоподібного палива (СО + Н2 – водяний газ), вихідна речовина при синтезі НСООН через HCOONa.
Вуглекислий газ СО2 використовують у вогнегасниках і для виготовлення газованої води. Ще у XVIII ст. Дж. Прістлі (Англія) збираючи СО2 над водою помітив, що частина його розчиняється у ній, надаючи приємного терпкого смаку. Додавши до такої води тільки цукор та ароматизатор одержують сучасні газовані напої. Твердий СО2 – «сухий лід».
Натрій карбонат Na2CO3 (кальцинована сода) у вигляді кристалогідрату Na2CO3×10Н2О (кристалічна сода) використовують у виробництві миючих засобів, скла, натрієвих солей, натрій гідрогенкарбонат NаHCO3 (питна сода) – у хлібопекарстві, як розпушувач тіста, калій гідрогенкарбонат КHCO3 (поташ) – при виготовленні скла, у фотографії, доломіт CaCO3×MgCO3 і магнезит MgCO3 – у виробництві цементу та будівельних матеріалів.
Домашнє завдання:
1.З кожного горизонтального рядка
викреслити формулу, що належить до іншого класу неорганічних сполук.
|
NaOH |
H2CO3 |
Ca(OH)2 |
|
CO2 |
SiO2 |
Na2CO3 |
|
NaHCO3 |
H2SO4 |
HNO3 |
·
Які речовини зайві?
·
До якого класу сполук вони належать?
2.Закінчити рівняння хімічних реакцій:
1. ![]() Са + H2CO3
Са + H2CO3
2. ![]() СО2 +Н2О + Ва(ОН)2
СО2 +Н2О + Ва(ОН)2
![]() 3. К2СО3 + НNO3
3. К2СО3 + НNO3
![]() 4. Mg (НCO3)2
4. Mg (НCO3)2
Урок за 12.05
Карбон – перший елемент IVА підгрупи. Проста речовина існує у формі кількох алотропних модифікацій: алмаз, графіт, карбін.
Алмаз – прозора кристалічна речовина. У кристалічній гратці алмазу (рис. 19.1, а) атомні орбіталі Карбону перебувають у стані sp3-гібридизації і утворюють чотири міцні ковалентні зв’язки. Така будова зумовлює високу твердість і хімічну стійкість алмазу. Алмаз не проводить електричний стум.
При нагріванні до 800 0С в атмосфері кисню алмаз згорає до СО2. Спаливши алмаз, А. Лавуазьє (Англія) у 1772 р. довів, що алмаз складається з Карбону.
Без доступу повітря утворює іншу алотропну модифікацію Карбону – графіт.
Графіт – сіро-чорна речовина з металічним блиском. Дуже м`який, добре проводить електричний струм, тугоплавкий, хімічно інертний матеріал. У графіту шарувата кристалічна гратка (рис. 19.1, б). Зв’язки між атомами Карбону в межах одного шару міцні, між шарами – слабкі. Гібридизація атомів карбону у молекулі графіту sp2.
Карбін – чорна дрібнокристалічна речовина, в природі не існує, її штучно одержують при дегідратації ацетилену НC≡CH при 1000 0С у присутності Cu2+. Атоми Карбону перебувають у стані sp-гібридизації. Це – напівпровідник.
Існують α-карбін або поліїн зі структурою –C≡C–C≡C– та β‑карбін (полікумулен), його структура =С=С=С=С=.
Нещодавно відкрита ще одна модифікація Карбону – фулерен – сферичні поверхні, що містять від 60 до 84 атомів Карбону.
Поширення у природі.
У природі у вільному стані Карбон зустрічається у формі алмазу та графіту. Вугілля, сажа, кокс – форми існування графіту.
У мінералах Карбон міститься у складі кальциту СаСО3, доломіту CaCO3×MgCO3 і магнезиті MgCO3.
Карбон входить до складу живої матерії, як основний структурний елемент усіх органічних речовин.
Фізичні властивості.
У будь-якій алотропній формі вуглець не має смаку і запаху, тугоплавкий і нерозчинний у воді та органічних розчинниках (крім фулеренів).
Графіт у формі вугілля завдяки пористій будові має високу адсорбційну здатність.
Адсорбція – концентрування різних речовин на поверхні поділу фаз (тверда-рідка, тверда-газова, рідка-газова, рідка-рідка).
Речовина, яка утримує на своїй поверхні частинки називається адсорбентом, речовина, яка утримується – адсорбатом.
Найвищу адсорбційну здатність має активоване вугілля, в якому спеціально очищають пори. Активоване вугілля використовують для очистки повітря в протигазах, видалення отруйних речовин з організму людини, очищення води тощо.
Хімічні властивості Карбону розглянемо на прикладі графіту.
За звичайної температури графіт хімічно інертний. При нагріванні реагує з неметалами (H2, F2, O2, N, S), металами, оксидами, кислотами.
І. З простими речовинами:
1. Безпосередньо реагує лише з фтором (з іншими галогенами не реагує):
C + 2F2 = CF4.
2. У реакції з киснем можливе утворення двох оксидів.
При нестачі кисню утворюється карбон (IІ) оксид:
який згоряє у надлишку кисню:
2CO + O2 = 2CO.
3. З сіркою реакція відбувається при 1000 0С:
C + 2S = CS2.
Сірковуглець CS2 розчиняє багатьох речовин.
4. При дії електричного розряду на суміш графіту та азоту утворюється диціан (CN)2 або C2N2:
Диціан називають псевдогалогеном. При взаємодії з воднем утворюється ціановодень (водні розчини – синильна кислота):
(CN)2 + Н2О = НCN.
Синильна кислота та її солі – ціаніди – сильні отрути.
5. За високої температури або наявності каталізатора (Ni/Pt) реагує з воднем з утворенням вуглеводнів:
C + 2H2 = CH4 (600 –
Ці сполуки розглянуто в розд. Органічна хімія.
6. З кремнієм при нагріванні утворюється карбід силіцію:
C + Si = SiC.
7. З металами при нагріванні утворює карбіди:
Карбіди бувають солеподібні (типу метану (Al4C3, Be2C) і типу ацетилену (CaC2)), ковалентні (SiC, B4C3) і металоподібні (Fe3C тощо).
При дії води або кислот на карбіди типу метану виділяється метан:
Al4C3 + 12H2O = 4Al(OH)3 + 3CH4, Al4C3 + 12HCl = 4AlCl3 + 3CH4.
Карбіди типу ацетилену утворюють ацетилен:
CaC2 + 2H2O = Ca(OH)2 + C2H2, CaC2 + 2HCl = CaCl2 + C2H2.
Ковалентні карбіди – хімічно інертні, дуже тверді речовини.
Металоподібні карбіди – тверді жаростійкі речовини, під дією кислот утворюють метан і водень:
Fe3C + 6HCl = 3FeCl2 + CH4 + H2.
ІІ. Зі складними речовинами.
1. Окиснюється концентрованою сульфатною або нітратною кислотами при 100 0С до СО2:
C + 2H2SO4к. = CO2 + 2SO2 + 2H2O,
C + 4HNO3к. = CO2 + 4NO2 + 2H2O.
2. Відновлює оксиди металів і неметалів:
FeO + C = Fe + CO, SiO2 +
Іноді при цьому утворюються карбіди:
2Al2O3 +
Метод відновлення оксидів вугіллям у металургії називають карботермією (див. Добування металів).
3. Розпечений до червоного кольору вуглець реагує з парою води:
C + H2O = CO + H2.
Утворюється водяний газ.
Застосування.
Алмаз застосовують у виготовленні шліфувальних матеріалів, прикрас, для різання скла, виготовлення прикрас – діамантів. Графіт застосовують для виготовлення графітових стержнів олівців, змазок і мастил завдяки легкості його розшарування. Графіт, будучи електропровідним, є хорошим матеріалом для виготовлення електродів.
Кам’яне вугілля використовують як паливо, адсорбент, відновник при виробництві фосфору з фосфориту, чорного пороху, у металургії (карботермія).
Силіцій. Кремній
Силіцій (лат. silex – кремінь) Si – типовий неметал і найближчий електронний аналог Карбону; знаходиться у IVА підгрупі ІІІ періоду Періодичної системи. Електронна структура зовнішнього енергетичного рівня атома Силіцію 3s23p23d
У сполуках з Оксигеном і неметалами виявляє ступінь окиснення +4 (рідше +2), у сполуках з Гідрогеном –2. Найстійкіший ступінь окиснення +4. У зв’язку зі зростанням атомного радіуса, порівняно з Карбоном, у Силіцію зменшується міцність міжатомних зв’язків, особливо в гомоатомних ланцюгах. На відміну від Карбону, Силіцій практично не утворює кратних зв’язків.
Відомі аморфний і кристалічний кремній, які відрізняються зовнішнім виглядом і властивостями, проте не є алотропними модифікаціями.
Вперше силіцій добув Й. Берцеліус (Швеція) у 1824 р.
Поширення у природі.
Силіцій – другий за поширенням елемент після Оксигену (27,6 % за масою) у Земній корі.
В природі Силіцій перебуває лише у зв’язаному стані: у вигляді силіцій діоксиду SiO2 (силікатний ангідрид, кремнезем) і у вигляді солей силікатних кислот – силікатів. Чистий SiO2 – гірський кришталь, кварц, забарвлений домішками оксидів металів – агат, аметист, яшма.
Найпоширеніші алюмосилікати: біла глина Al2O3×2SiO2×2H2O, польовий шпат K2O×Al2O3×6SiO2, слюда K2O×Al2O3×6SiO2×H2O.
Багато силікатів у чистому вигляді є дорогоцінними каменями – аквамарин, топаз, ізумруд.
Як Карбон, входячи до складу усіх живих речовин, є найважливішим елементом живої природи, так Силіцій – основний елемент неживої природи. Більшість гірських порід містять сполуки Силіцію: граніт, глини, пісок.
У живій природі Силіцій міститься у діатомових водоростях, хвощах, кремнієвих губках, іноді входить до складу пір’я, шерсті.
Одержання.
Кремній одержують прожарюванням білого піску SiO2 з магнієм:
SiO2 + 2Mg = Si + 2MgO.
При цьому утворюється аморфний кремній у вигляді білого порошку. Кристалізацією аморфного кремнію добувають кристалічний кремній з металічним блиском.
У промисловості кристалічний кремній одержують відновленням SiO2 в електропечах:
SiO2 + C = Si + CO2.
Найчистіший кремній добувають за реакціями:
SiCl4 + 2Zn = Si + 2ZnCl2, SiH4 = Si + 2H2.
Фізичні властивості.
Аморфний кремній – бурий порошок з т. пл. 1420 0С, неелектропровідний.
Кристалічний кремній – тверда речовина сірого кольору з металічним блиском, тепло- і електропровідний. Напівпровідникові властивості обумовлені будовою кристалу, яка аналогічна алмазу. Проте зв’язки в кристалі значно слабкіші, ніж в алмазу і за н.у. частина з них розірвані, а тому в кристалі є вільні електрони, наявність яких і зумовлює незначну тепло- і електропровідність. При нагріванні розривається більше зв’язків, тому тепло- і електропровідність зростає.
Хімічні властивості.
За н.у. кремній – інертний елемент, за кімнатної температури реагує лише з фтором:
Si + 2F2 = SiF2.
При високих температурах реагує практично з усіма неметалами (C, O2, S, N2, Cl2, Br2) з утворенням відповідних бінарних сполук:
Si + C = SiC, 3Si + 2N2 = Si3N4, Si + O2 = SiO2,
Si + 2S = SiS2, Si + 2Cl2 = SiCl4.
Галогеніди кремнію гідролізують у водних розчинах лугів:
6SiF4 + 12NaOH = 4Na2SiF6 + 2Na2SiO3 + 6H2O.
Кремній не реагує з кислотами і водою, розчиняється лише у суміші HF і HNO3:
3Si + 12HF + 4HNO3 = 3SiF4 + 4NO + 8H2O,
та у розчинах лугів:
Si + 2KOH + H2O = K2SiO3 + 2H2.
У цих реакціях Силіцій – відновник.
При сплавленні з металами кремній утворює силіциди, виступаючи при цьому окисником:
2Mg + Si = Mg2Si.
При дії хлоридної кислоти на Mg2Si утворюється силан:
Mg2Si + 4HCl = 2MgCl2 + SiH4.
Силан SiH4 – безбарвний отруйний газ, самозаймається на повітрі:
SiH4 + 2О2 = SiО2 + 2Н2О.
Застосування.
У техніці кремній використовують для виготовлення напівпровідників. Сплав заліза з кремнієм (феросиліцій) використовують у виготовленні деталей заводської жаро- та хімічностійкої апаратури.
Високотвердий сплав кремнію з графітом – карборунд – з кристалічною граткою алмазу використовують для виготовлення наждачного паперу і точильних кругів. Відкрив карборунд випадково Е. Ачесон (США) (1856 – 1931) при спробі добути алмаз шляхом нагрівання вугілля у присутності глини при високій температурі.
Натрій гексафторосилікат Na2SiF6 – отруйна речовина, використовують як інсектицид (отрута для боротьби з комахами).
Фторосилікати магнію, цинку, алюмінію використовують у будівництві для створення водонепроникного шару на поверхні будматеріалів.
Домашнє завдання:Здійснити ланцюг перетворень
С⇨СO⇨СO2⇨СаСO3⇨Н2СО3
Урок за 19.04
Домашнє завдання:опрацювавши параграф в посібникук хімія 8 клас частина №4 заповніть таблицю
|
|
Нітроген (І)оксид |
Нітроген (ІІ)оксид |
Нітроген (ІІІ)оксид |
Нітроген (ІV)оксид |
Нітроген (V)оксид |
|
Хімічна формула
|
|
|
|
|
|
|
Назва |
|
|
|
|
|
|
Фізичні властивості |
|
|
|
|
|
|
Знаходжень- ня
в природі |
|
|
|
|
|
|
Добування |
|
|
|
|
|
|
Застосування |
|
|
|
|
|
Урок 15.04
Азот і Фосфор як прості речовини:
будова молекул, поширення в природі
Азот N2 - єдина проста речовина Нітрогену. В повітрі його об'ємна частка складає 78,09 %. Сполуки Нітрогену в невеликих кількостях містяться в грунті. Разом із Карбоном, Гідрогеном і Оксисеном Нітроген входить до складу багатьох органічних речовин, що містяться в рослинах, мікроорганізмах, тваринах, людині. Серед цих сполук найважливішими для життя є амінокислоти та їхні похідні - білки.
Будова молекул азоту.
Молекули азоту складаються з двох атомів Нітрогену, з'єднаних за допомогою трьох електронних пар.
Молекулярна формула азоту N2
Електронна формула молекули азоту ![]()
Структурна формула ![]()
Зв'язок, утворений трьома електронними парами, називають потрійним. Молекула азоту завдяки потрійному зв'язку є дуже стійкою.
Фосфор: поширення в природі
Простих речовин Фосфору в природі не існує через їх хімічну активність. Він трапляється в природі лише у вигляді неорганічних і органічних сполук.
Найважливішими мінералами, що містять Фосфор, є фосфорит ![]() і апатит
і апатит ![]() (Х - однозарядний аніон, ним може бути
(Х - однозарядний аніон, ним може бути ![]() ).
).
Фосфор є одним із біоелементів. Фосфати Кальцію є неорганічною основою кісток і зубів. Фосфор також входить до складу білкових речовин. Органічними сполуками Фосфору є нуклеїнові кислоти, які відповідають за спадковість.
Масова частка Фосфору в організмі людини становить 1%. Щоденна потреба людини у Фосфорі - майже 1,2 г. Вона задовольняється переважно за рахунок споживання хліба і молока. Найбільше Фосфору міститься в таких продуктах харчування, як м'ясо, риба, квасоля, яйця.
Фізичні властивості Азоту
Азот - безбарвний газ без запаху і смаку. При охолодженні до -190°С (при тиску 101,3 кПа) він перетворюється на безбарвну рідину, яка при -210°С твердне. Азот має незначну розчинність у воді: у 100 г її розчиняється лише 2,9 мг газу (при 0°С і 101,3 кПа).
Рідкий азот використовується для створення низьких температур, ним охолоджують різні ємкості і обладнання.
Хімічні властивості азоту
Азот є речовиною дуже пасивною щодо хімічних перетворень. Це пояснюється особливою стійкістю молекул N2 , що спричинена потрійним зв'язком між атомами. Азот - типовий неметал, один з найбільш електронегативних елементів в природі, і для нього характерна реакція з металами. При цьому утворюються нітриди металів.
За звичайної температури азот реагує лише з літієм: ![]()
З багатьма іншими металами азот реагує при нагріванні. Так, при горінні магнію на повітрі одночасно з оксидом магнію утворюється нітрид магнію:![]()
Серед неметалів лише деякі реагують з азотом, причому за особливих умов. З воднем реакція відбувається при високій температурі (500°С) і тиску, у присутності каталізатора - Fe.
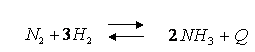
З киснем азот сполучається за температури електричної дуги, понад 2000 °С, утворюючи оксид нітрогену (ІІ):
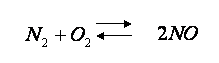
Під час грози навколо блискавки повітря миттєво нагрівається до високих температур, і відбувається реакція між азотом і киснем.
Азот є хімічно пасивним щодо води, кислот, лугів, багатьох інших сполук.
Хімічні властивості Фосфору
Білий, червоний та чорний фосфор мають практично однакові хімічні властивості, але через різну будову речовини сильно відрізняються за хімічною активністю. Найактивніший є білий фосфор. При нагріванні на повітрі до 50 °С, ударі чи терті він спалахує, а за звичайних умов повільно окиснюється киснем із виділенням енергії у вигляді світла. Зберігають білий фосфор під водою, в якій він не розчиняється і до якої є хімічно інертним. Червоний і чорний фосфор загоряються при підпалюванні. Реакція в разі надлишку кисню відбувається з утворенням фосфору (V) оксиду: ![]()
Якщо кисню недостатньо, то продуктом реакції є фосфор (ІІІ) оксид. Складіть рівняння цієї реакції.
З воднем фосфор практично не взаємодіє.
Фосфор реагує з металами з утворенням фосфідів:
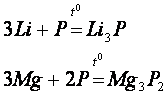
Застосування азоту
Рідкий азот використовується для створення низьких температур; ним охолоджують різні ємкості і обладнання.
Застосування фосфору
На практиці використовують в основному червоний фосфор, оскільки білий є вкрай вогненебезпечним і дуже отруйним. Найбільше фосфору витрачається на виробництво ортофосфорної кислоти, яка є вихідною речовиною для добування фосфорних добрив.
Червоний фосфор застосовують для виготовлення сірників. З нього, сульфіду стибію (ІІІ)![]() , залізного сурику (природного оксиду феруму (ІІІ)
, залізного сурику (природного оксиду феруму (ІІІ) ![]() з домішкою кварцу
з домішкою кварцу ![]() ) і клею виготовляють суміш, яку наносять на бокову поверхню сірникової коробки. Головки сірників складаються з хлорату калію
) і клею виготовляють суміш, яку наносять на бокову поверхню сірникової коробки. Головки сірників складаються з хлорату калію ![]() , молотого скла, сірки та клею. Під час тертя головки по боковій поверхні сірникової коробки червоний фосфор займається, підпалює головку, а від неї загоряється дерево.
, молотого скла, сірки та клею. Під час тертя головки по боковій поверхні сірникової коробки червоний фосфор займається, підпалює головку, а від неї загоряється дерево.
Одна з реакцій, що відбувається при цьому за участю фосфору, описується схемою:
Домашнє завдання:Здійснити ланцюг перетворень
N2⇨NO⇨NO2⇨HNO3⇨KNO3
P⇨P2O5⇨H3PO4⇨Ba3(PO4)2⇨AlPO4⇨H3PO4
Урок за 14.04
Урок за 12.04
4.1 Загальна характеристика елементів V А групи
До елементів V А групи належать Нітроген 7N, Фосфор 15Р, Арсен 33Аs, Стибій 51Sb та Бісмут 83Ві. За аналогією з галогенами та халькогенами для них запропонована загальна назва "пніктогени" (в перекладі з грецької – задушливі, ті, що мають поганий запах, які особливо відноситься до водневих сполук цих елементів).
В основному стані атоми елементів V А групи мають електронну конфігурацію зовнішнього шару ns2nр3, з трьома неспареними р-електронами. В ряду N – Р – Аs – Sb – Ві розміри атомів збільшуються, а енергії йонізації зменшуються, що призводить до підсилення металевих властивостей: у вільному вигляді Нітроген та Фосфор – типові неметали, Арсен та Стибій – металоїди, Бісмут – метал. Зі зростанням радіуса збільшуються і координаційні числа (КЧ) атомів. Для Нітрогену характерні координаційні числа 1–4, для Фосфору зазвичай реалізується КЧ = 4, але в сполуках з галогенами КЧ може досягати 6, Арсен та Стибій проявляють КЧ 4, 6, а бісмут – 7, 8, 9.
Внаслідок невеликого радіуса та високої електронегативності Нітроген відрізняється від інших елементів своєї підгрупи. Відсутність у нього енергетично доступного вакантного d-підрівня призводить до того, що атом Нітрогену може утворювати не більше чотирьох ковалентних зв'язків, в тому числі один зв'язок за донорно-акцепторним механізмом.
У зв'язку із зростанням радіуса атома і зменшенням перекриття атомних р-орбіталей, міцність одинарних σ-зв'язків у ряду N–Р–Аs–Sb–Ві зменшується. Менша міцність зв'язку N–N порівняно зі зв'язком Р –Р зумовлена малим розміром атомів Нітрогену та виникаючим внаслідок цього сильним міжелектронним відштовхуванням. Міцність кратних зв’язків, навпаки, зменшується із зростанням розміру атомних орбіталей, та, як наслідок, послабленням їх перекриття за π-типом. Таким чином, найміцнішими виявляються кратні (потрійні) зв’язки для Нітрогену. Для Фосфору та Арсену енергетично вигіднішим є утворення одинарних зв'язків.
Елементи V А групи виявляють різні ступені окиснення. Для Нітрогену характерний весь спектр – від -3 до +5 (-3, -2, -1,+1, +2, +3, +4, +5). Для Фосфору негативні ступені окиснення є менш характерними, ніж для Нітрогену. В той же час стійкість сполук з вищим ступенем окиснення збільшується, що пов'язано зі зменшенням електронегативності атома Фосфору, зменшенням енергії йонізації та збільшенням міцності зв'язків. Арсен та Стибій у сполуках мають ступені окиснення -3, +3 та +5, а для Бісмуту найстійкішими є сполуки зі ступенем окиснення +3.
Елементи V А групи в ступені окиснення +3 зберігають неподілену електронну пару, яка зумовлює їх стехіометрію та донорні властивості.
Завдяки сумарній дії різних факторів (зростанню атомного радіуса, зменшенню рπ-рπ–перекриття, збільшенню ступеня екранування зовнішніх електронів) стійкість та окисювальна здатність сполук Фосфору на наступних за ним елементів підгрупи змінюється немонотонно (вторинна періодичність) – вищий ступінь окиснення є найбільш стійким для Фосфору та Стибію, в той же час сполуки Арсену та особливо Бісмуту зі ступенем окиснення +5 часто є нестійкими чи взагалі не існують. Сполуки Бісмуту(V) – сильні окисники.
Для кисневих сполук Фосфору та, в меншій мірі, для наступних елементів групи має місце рπ-dπ – перекриття, яке підвищує кратність зв'язку Е–О та збільшує його енергію. Тому сполуки Фосфору практично не виявляють окиснювальних властивостей, на відміну від аналогічних сполук Нітрогену.
4.2 Знаходження у природі
У вигляді простої сполуки – азоту N2 – в природі знаходиться лише Нітроген (його вміст у повітрі складає приблизно 78%). Вміст Нітрогену в земній корі складає 2,5·10-3 мас.%. З природних мінералів промислове значення має чілійська (NaNO3) та калійна (КNO3) селітри.
Фосфор зустрічається у вигляді фосфатів, його вміст у земній корі складає 0,1 мас.%. Найбільш розповсюдженими мінералами є апатити – гідроксоапатит Са5(РО4)3ОН, фторапатит Са5(РО4)2F, а також фосфорит Са3(РО4)2.
Арсен (1,5·10-4 мас.%), Стибій (2·10-5 мас.%), Бісмут (5·10-6 мас.%) зустрічаються переважно у вигляді сульфідів – аурипігменту Аs2S3, антимоніту або стибійного блиску Sb2S3, бісмутового блиску Ві2S3, арсенопіриту FеАsS, тетрадиміту Ві2Те2S, а також оксигенвмісних сполук, наприклад, скородиту FеАsО4·2Н2О, бісмутової охри Ві2О3 тощо.
4.3 Фізичні властивості та алотропія
За звичайних умов азот N2 – газ без кольору, запаху і смаку, малорозчинний у воді (2,3 мл/100г Н2О при 0°C). Міцний внутрішньомолекулярний зв'язок, невеликий розмір та неполярність молекули N2 є причинами слабкої міжмолекулярної взаємодії, тому азот має низькі температури плавлення та кипіння (-2100С та -1960С відповідно).
Всі інші елементи V А групи за кімнатної температури – тверді речовини, мають декілька алотропних модифікацій.
Для Фосфору відомі три алотропні видозміни: білий, червоний та чорний.
Чорний фосфор – найбільш стійка модифікація, утворюється з білого за нагрівання до 220 оС та за дуже високого тиску (1200 атм.). За зовнішнім виглядом він нагадує графіт та є напівпровідником. |
Арсен, стибій та бісмут, як і фосфор, існують у вигляді декількох модифікацій. Жовтий арсен Аs4 за будовою нагадує білий фосфор. При зберіганні він самовільно перетворюється в більш стійку гексагональну форму, що за будовою нагадує чорний фосфор. Вона є найбільш стійкою також для стибію та бісмуту.
У ряду від фосфору до бісмуту зростають координаційні числа, з'являється металевий блиск, зменшується крихкість та збільшується електропровідність.
Домашнє завдання:параграф 41,виконати завдання
- Напишіть рівняння реакцій, за допомогою яких можна здійснити перетворення:
NH3 → N2 → NO → КNO3 → O2;
Урок за 08.04
Пам'ятайте,що після введення коду у Вас є 1 спроба та 45 хвилин для виконання тесту!
Завдання необхідно виконати до 8 квітня 23:00
Урок за 07.04
Домашнє завдання:Скласти кросворд на 10 питаня за темами параграфів36-40 частини №4
Підготуватись до контрольної роботи
Виконане дз за 05.04 та 07.04 надіслати мені на електронну пошту до 20:00
Урок за 05.04
Тема:Розв'язування вправ та задач
Для реакцій 4, 5, 10, 11 — скласти ОВР, реакції 6, 7, 8, 9 написати в іонно-молекулярній формі.
б) NO2 HNO3
NH4NO3
NH3
(NH4)2SO4
Завдання 2. Допишіть рівняння практично здійсненних реакцій (двоє учнів біля дошки, решта — за варіантами в зошитах).
Завдання 3. Обчисліть масу солі, що утворилася, якщо в реакцію вступило 34 г ферум(ІІІ) оксиду й 19,6 г сульфатної кислоти.
Для розв'язку завдання скористайтеся підказкою
1. Складіть рівняння реакції
2.Обчисліть молярні маси всіх речовин у рівнянні крім води
3.Знизу під рівнянням реакції підпишіть молярні маси речовин(під кожною речовиною її молярну масу)
4. Над речовинами зверху у рівнянні реакції підпишіть що відомо із дано, як Х позначте що треба знайти.
5. знайдіть Х
виконані завдання принести на наступний урок
Урок за 01.04
1.закінчити рівняння реакцій
SO2 + H2O →
SiO2 + H2O→
N2O5 + H2O → SO3 + H2O →
SO3 + H2O → CO2 + H2O →
2.Здійснити
перетворення
Na → Na2O → NaOH → NaHSO4
3.Напишіть
рівняння реакцій у молекулярній, повній та скороченій йонній формах.
Na2SO4 + BaCl2 →
СuSO4 + КОН →
Виконані завдання принести на наступний урок
Урок за 25.01
Тема:Якісні реакції на йони лужноземельних металів
Повторити матеріал минулого уроку
Дз: здійснити перетворення
Урок за 21.01
Тема:Сполуки елементів ІІ групи головної підгрупи ПС.
Урок за 20.01
Тема:Порівняльна характеристика елементів ІІ групи головної підгрупи.
Дз: знайти інформацію про будь-який елемент ІІ групи головної підгрупи ПС
виконане дз та надіслати на пошту Scherbinka92@gmail.com 20.01 до 20:00
Урок за 18.01
Тема:Виконання вправ і задач
Розв’язання
1. Для одержання магній оксиду магній потрібно спалити в кисні:
4. Магній сульфат можна одержати, доливши до одержаного магній гідроксиду розчин сульфатної кислоти:
5. Барій сульфат можна одержати лише при взаємодії магній сульфату з розчинною у воді сіллю Барію, наприклад, барій нітратом чи барій хлоридом:
Дз:виконати ланцюг перетворень
Na2O → NaOH → Na2CO3 → CO2 → BaCO3 → BaO
виконане дз та надіслати на пошту Scherbinka92@gmail.com18.01 до 20:00
Урок за 14.01
Тема:Сполуки Лужних металів,поширеність у природі
Дз:опрацювати параграф,виконати завдання #1 та 3 на фото,або підготуйте інформацію про будь-яку сполуку Натрію чи Калію
Урок за 13.01.
Тема:Елементи головної підгрупи І групи ПС.
Домашнє завдання:Виконати вправу.Зразок виконання є на наступному відео
Написати
рівняння наступних перетворень:
К → КОН → К2СО3
→ СО2
Домашнє завдання:виконане дз та надіслати на пошту Scherbinka92@gmail.com13.01 до 20:00
Урок за 11.01
Тема:Хімічні властивості металів. Лабораторний дослід№2
Домашнє завдання:оформити лабораторну роботу та надіслати мені на
пошту Scherbinka92@gmail.com 11.01 до 20:00
Тестове завдання «Хімічний калейдоскоп»(знайти відповіді на питання у додаткових джерелах)
1) Метал з
найвищою електропровідністю
2) Найважчий метал
3) Найлегший метал
4) Найпластичніший
метал
5)
Рідкий метал за нормальних умов
6) Найтвердіший метал
7) Найм’якіший метал
8) Кольоровий метал
9) Найбільш тугоплавкий метал
10) «Найчорніший»
метал
11)
Метал – феромагнетик
12) Метал жовтого кольору
Хімічні властивості металів.
Лабораторний дослід№2
Тема:Дослідження хімічних властивостей металів(Вам слід після кожного відео досліду описати свої спостереження та дописати рівняння реакцій)
Мета:дослідити загальні хімічні властивості металів,навчитися складати рівняння реакцій
Обладнання:відео дослідів,зошит
Хід роботи
1)Взаємодія з простими речовинами.
Найбільш енергійно метали реагують з неметалами ( реакції сполучення).
А) взаємодія з галогенами:
-
Горіння натрію з хлором
Na + Cl2 = дописати рівняння та урівняти коефіцієнти
-
взаємодія заліза з хлором
Fe + Cl2 = дописати рівняння та урівняти коефіцієнти
Б) взаємодія з киснем: Горіння Алюмінію
-
активні метали окиснюються швидко (Na-плавиться,
К-вибухає)
-
взаємодія з Алюмінієм
АІ + O2 = дописати рівняння та
урівняти коефіцієнти
2)Взаємодія з складними речовинами ( реакції заміщення).
А) взаємодія з водою.
-
взаємодія натрію з водою
Na + H2O = дописати рівняння та
урівняти коефіцієнти
Б) взаємодія з розчинами кислот
Взаємодія металів з розчином хлоридної кислоти.
Zn + HCl = дописати
рівняння та урівняти коефіцієнти
Си+ HCl = дописати
рівняння та урівняти коефіцієнти
Sn+ HCl = дописати
рівняння та урівняти коефіцієнти
В) взаємодія з розчинами солей.
-
Різниця в активності дозволяє одним металам витісняти
інші з розчинів їх солей.
-
Взаємодія заліза та цинку з розчином купрум сульфату
-
Що спостерігаємо? Які ознаки проходження реакції?
Fe + CuSO4 = дописати рівняння та
урівняти коефіцієнти
- Zn+ CuSO4 = дописати рівняння та урівняти коефіцієнти
Оформіть висновок до Лабораторної роботи(Що вивчали,які
реакції бачили,які метали взаємодіяли,що досліджували)
Урок за 26.11
Тема:Семінар:Значення окисно-відновних реакцій у природі та техніці
АЛГОРИТМ СКЛАДАННЯ ЕЛЕКТРОННОГО БАЛАНСУ
На прикладі розглянемо порядок складання електронного балансу, за допомогою якого можна урівнювати складні
окисно-відновні реакції.
1)
У записаному рівнянні реакції визначити ступені окиснення
всіх елементів.
2) Визначити, які
елементи в процесі хімічної реакції змінюють ступінь окиснення.
3)
Записати окремо процеси окиснення та відновлення з
указівкою кількості електронів, що беруть участь у кожнім процесі.
4) Визначити
окисник і відновник.
5) Визначити
коефіцієнти, на які необхідно помножити рівняння окиснення й відновлення, щоб
кількість електронів, відданих відновником і прийнятих окисником, була
однаковою.
6)
Просумувати рівняння окиснення й відновлення з
урахуванням отриманих коефіцієнтів або розставити відповідні коефіцієнти у
вихідному рівнянні.
Оформлення окисно-відновної реакції з електронним балансом повинно
виглядати таким чином:
H2+1S-2 + O20 → S+4O2-2 + H2+1O-2
![]()
![]()
![]() Окисник O20 +4е→ 2O-2 НСК 3
відновлення
Окисник O20 +4е→ 2O-2 НСК 3
відновлення
Відновник S-2-6е → S+4 12 2 окиснення
2H2S + 3O2 → 2SO2
+ 2H2O
НСК шукається для кількості прийнятих та відданих електронів
Домашнє завдання:виконане дз та надіслати на пошту Scherbinka92@gmail.com 26.11 до 20:00
Урівняти методом електронного балансу
CuSO4 + Fe → FeSO4 +
Cu ;
KCl + F2 → KF + Cl2
;
KMnO4 + HCl → KCl +
MnCl2 + Cl2 + H2O .
Урок за 25.11
Тема:ОВР. Зрівнювання рівнянь методом електронного балансу.
Перегляньте відео. Виконайте завдання
1. «Допиши речення»
1.Реакції, які відбуваються зі зміною ступеня окиснення називають…2.Число прийнятих або відданих електронів під час окисно-відновної реакції називають…
3. При втраті
електронів ступінь окиснення…
4. При
отриманні електронів ступінь окиснення…
5. У простих
речовин ступінь окиснення дорівнює …
6. Процес втрачання електронів частинкою речовини називають…
7. Процес приєднання електронів частинкою речовини…
8. Частинка
речовини, яка отримує електрони й
відновлюється називається…
9. Частинка, яка втрачає електрони й окислюється називається…
2.Визначити ступінь окиснення речовин:
HCIO2 CuSO4
Н2CaCO3 СІ2AgNO3СаHNO3Mg
3.Напишіть для кожного рівняння який процес відбувається(окиснення чи відновлення) та ким являється елемент(окисником чи відновником)
в) Al0 – 3ē → Al+3; г) S0 + 2ē → S–2.
д) Cr+2 – 1ē → Cr+3; е) S+6 + 8ē → S–2.
Урок за 12.11
Тема: Йонний зв'язок
Домашнє завдання:параграф 20 №3
виконане дз та надіслати на пошту Scherbinka92@gmail.com 12.10 до 20:00
Урок за 12.10
Тема: Виконування вправ з еми Періодичний закон та Періодична система
На основі вже вивченого матеріалу виконати завдання та надіслати на пошту Scherbinka92@gmail.com 12.10 до 20:00
2 Частина простору навколо ядра, де найімовірніше перебування електрона?
3 Хто відкрив α-, β- та γ-випромінювання?
4Що таке період?
5) Яка підгрупа називається побічною?
6) Хімічно неподільна частинка речовини?
7) Ядра атомів складаються з …
8) В якому році та ким була запропонована планетарна модель будови атома?
9) Чому дорівнює номер групи?
10) Чому дорівнює порядковий номер хімічного елемента?
11) Графічне зображення періодичного закону – це …
12) Автор Періодичного закону?
13) Атомні орбіталі можуть мати форму …
14) Як називаються хімічні елементи VIII групи головної підгрупи?
15) Чому дорівнює номер періоду?
2.Охарактеризуйте за планом елементи № 17,36,78
- Представник якої родини
- Порядковий номер
- Відносна атомна маса
- Заряд ядра атома
- Кількість електронів
- Кількість протонів
- Кількість нейтронів
- Валентність
- Формула вищого оксиду
- Формула водневої сполуки
- Електронна формула
- Графічне зображенн
- Кількість електронів на зовнішньому рівні, кількість спарених та неспарених електронів





































Ета капец
ВідповістиВидалитиВладік що за дописи?Якщо щось не зрозуміло-зв'яжись зі мною,а не пиши коментарі
Видалити